
|
|
|
|
Pour utiliser utilement cette page vous devez être
en possession de vos résultats expérimentaux.
|
|
|
1.1 Peser la masse de chlorure de cuivre.
|
La masse volumique est une grandeur utilisée
pour comparer la quantité de matière que représentent
divers échantillons de solides ou de liquides
|
|
|
Manipuler avec précaution
|
|
|
Ne pas prélever de solide dans le bécher posé sur
la balance
|
|
|
Ne pas reverser le solide prélevé en excès dans la
réserve de produit chimique afin de conserver sa pureté.
|
|
|
Protocole : Peser.
|
|
|
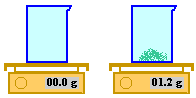
Poser un bécher propre et sec (ou un verre de montre) sur le
plateau de la balance
|
|
|
Tarer le récipient. La balance affiche : 00.0 g.
|
| |
 |
La balance ajoute à la masse du plateau
la masse du bécher. Elle n'affichera plus que la masse de
produit pesé. Le tarage en cours d'exécution du protocole
s'effectue en appuyant une fois sur le bouton «On/Off -
Tare» de la balance.
|
|
|
|
A l'aide d'une spatule, verser lentement le solide, jusqu'à ce
que la masse affichée soit (à 0,1 g près) la masse désirée.
|
|
|
Noter le résultat :
|
|
1.2 Mesurer le volume d'eau.
|
|
|
Protocole : Mesure d'un volume de liquide
à la pipette jaugée
|
|
j
|
Tarer l a balance alors qu'elle supporte un tube à essais propre
et sec muni son bouchon.
|
|
k
|
Avec un pipeteur l'eau est aspirée jusqu'à ce qu'elle atteigne
le trait de jauge supérieur de la pipette.
|
|
l
|
Ajuster le niveau en veillant bien à viser horizontalement le
bas du ménisque.
|
|
|
 |
Bien que la pipette soit munie d'une boule de sécurité,
on doit toujours utiliser un pipeteur pour prélever les
liquides.
|
|
|
m
|
La pipette est vidée dans le tube à essais. Ne pas oublier d'arrêter
le niveau au second trait de jauge qui détermine la volume prélevé
:
(car 1 mL = 1 cm3)
|
|
n
|
Repérer la niveau avec un feutre ou un élastique
|
|
o
|
Fermer le tube et peser la masse d'eau
(µo = 1g/cm3 Û Si le volume était exactement
10 mL = 10 cm3 la masse devrait être mo = 10 g)
|
|
1.3 Réalisation du mélange.
|
| |
Définitions ...
|
|
|
|
Le soluté est le corps mis en solution.
|
|
|
Le solvant est le corps qui dissout le soluté.
|
|
|
|
|
Protocole : Mise en solution.
|
|
j
|
Introduire l a totalité du soluté, avec soin, dans le tube à
essais contenant l'eau.
(Utiliser le petit entonnoir pour ne perdre aucune parcelle de
produit.)
|
|
|
 |
Verser lentement le soluté dans
le solvant ce qui permet de contenir une réaction violente
imprévue. |
| Le tube est bouché avec un bouchon,
jamais avec le doigt, car le mélange de deux produits inoffensifs
peut être nocif ! |
|
|
k
|
Le tube, bouché, est agité jusqu'à dissolution complète.
|
|
l
|
Le liquide homogène obtenu est une solution
|
|
m
|
Pour les petites quantités de soluté le volume ne varie pratiquement
pas mais il augmente sensiblement pour les quantités les plus
importantes
|
|
n
|
Le volume de la solution est
|
|
o
|
Le tube bouché est posé sur la balance. La masse de la solution
est
|
|
p
|
La masse de la solution est la somme des masses de soluté et
de solvant :
m = mo + ms
|
|
1.4. Caractérisation de ma solution
|
|
|
Ma solution peut être caractérisée par sa masse volumique :
|
|
|
|
|
2.1. Récapitulation.
|
|
|
2.2. Observations.
|
Les tubes sont rangés sur un support, dans l'ordre croissant
des masses de soluté dissoutes :
|
 |
|
Plus la masse de soluté est importante plus la couleur bleu turquoise
de la solution est intense, virant au vert pour les solutions
très concentrées.
|
|
La coloration de la solution de chlorure de cuivre augmente avec
sa masse volumique
|
|
Mais la masse volumique ne rend pas bien compte de la proportion
en masse de soluté, car toutes les masse volmiques calculées
restent voisines de
µ = 1 g/cm3
|
|
|
|
| |
Ce qu'il faut retenir
...
|
|
|
|
Une solution
est un liquide homogène résultant de la dissolution d'un corps
solide ou liquide dans un liquide.
|
|
|
Le soluté
est le corps dissout dans le liquide.
Le soluté peut être un solide ou un liquide.
|
|
|
Le solvant
est le corps dans lequel est dissout le soluté.
|
| |
Suivant la nature du solvant on obtient :
|
| |
|
|
© Villafruela Daniel
mise à jour le
5-12-2001
|
|
|
|